在Structures & Bondings一課向大家簡介物質可簡單分為4種結構。其中一種為簡單分子結構Simple Molecular Structure,顧名思義即是一粒粒的簡單分子如二氧化碳或水的分子組成、分子之間由范德華力互相連結。
范德華力亦是靜電力(electrostatic force)的其中一種,分子的正負極就是來自上次講過的極性分子(polar molecule)︰知果分子中的原子來自不同元素就會產生極化(polarization),電負性低一方原子帶微正電而電負性高一方帶微負電。在該物質中,某分子的微正極方就會和另一分子的微負極方產生吸引力。這就是范德華力︰
1 molecule
|
Numerous molecules
|
|
|
|
問題是非極性分子(non-polar molecule)沒有具微正負極,分子間又何來范德華力?那我們可以先想像,如果某物質的粒子之間沒有任何吸引力,它就不會組成固體及液體。
但仔細想想非金屬物質,某幾個由非極性分子組成的物質如溴(bromine)及碘(iodine)的溶點及沸點絕對不會是-273度(在常溫下前者為液體而後者為固體)。這證明分子間依然存在范德華力。
哪正負極又從何而來?細個大家冬天應該試過磨擦間尺來製作靜電、吸起紙碎。紙碎本身沒帶電荷,但在間尺靜電的影響之下就會感生出正負電荷。此現象稱為靜電感應 (electrostatic induction)︰
在非極性分子中一樣出現靜電感應。受到附近極性物質或電荷影響下,非極性物質會極化而出現正負極。當一粒非極性分子具微電荷,它就會感應其他非極性分子,造成骨牌效應︰
影響范德華力的因素主要有兩種。第一為分子大小(Molecular size),分子越大意味著電子越多、越容易受外界影響而感生出正負電荷,所以越能和其他分子產生范德華力。
Noble
gas
|
Relative
molecular size
|
Boiling
point (℃)
|
|
Helium
|
He
|
-245.7
|
|
Neon
|
Ne
|
-185.6
|
|
Argon
|
Ar
|
-157.2
|
|
Krypton
|
Kr
|
-111.3
|
|
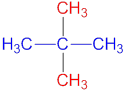
第二為分子形狀(molecular shape),這通常用於比較有機化學中具一樣分子式但不同砌法的分子(即是結構異構物structural isomer,這概念將於有機化學的部分再深入探討)。倒如C5H12一分子式可以衍生出兩種不同結構的分子︰
Chemical
name
|
Pentane
|
Methylbutane
|
Dimethylpropane
|
Molecular
formula
|
C5H12
|
||
Structural
formula
|
|
|
|
Boiling
point (℃)
|
36.0
|
27.8
|
9.5
|
Melting
point (℃)
|
-129.8
|
-161
|
-16.6
|
分子形狀決定分子可和其他分子組成多少范德華力。而它對固體和液體都有不同影響︰
有機分子的結構簡單來說由直鏈(straight chain,上圖藍色部分)和支鏈(branch group,上圖紅色部分)組成。一個分子越多支鍵,表面積就相對較細,越難和周圍其他分子組范德華力。所以分子中較多支鏈的物質會有較低的沸點(Boiling point)。
但在固體的情況則有不同,越對稱的分子能堆疊得更有效率(effective
packing),所以Dimethylpropane的溶點比Pentane高。而methylbutane在三個分子中最不對稱,所以溶點(Melting point)最低。
或有同學認為Pentane的結構不是應該堆砌得更好嗎?如果單憑上圖的分子結構的確會覺得這說法成立,但我們需考慮分子的3D結構︰Pentane的分子具Z字形(Zig-zag shape),而且其單鏈在液態或氣態的情況可以自由轉動(稱為bond rotation)。所以會出現以下結構︰
這些不同形式的Pentane分子就會妨礙互相堆砌的效率、組成的范德華力相對較少。而Dimethylpropane的碳鏈即使如何轉動亦不會影響其結構,所以堆砌得較好,溶點自然更高。
Substance
|
Pentane
|
Methylbutane
|
Dimethylpropane
|
Stacking
in solid state
|
|
|
|
Melting
point (℃)
|
-129.8
|
-161
|
-16.6
|





















沒有留言:
張貼留言