上次講完Molecular geometry之後可能好多同學都唔知有咩用,所以今次講埋共價鍵的極性(Bond polarity)和分子極性(Molecular polarity)之後大家應該會有多少少idea。不過要講呢D概念之前要先學咩野係電負性(Electronegativity)。
非金屬原子之間為了變得穩定就要組成共價鍵,鍵內的電子理應是兩粒原子之間平均分配,但事實上要視乎該原子的電負性。電負性就是指某原子核(nucleus,
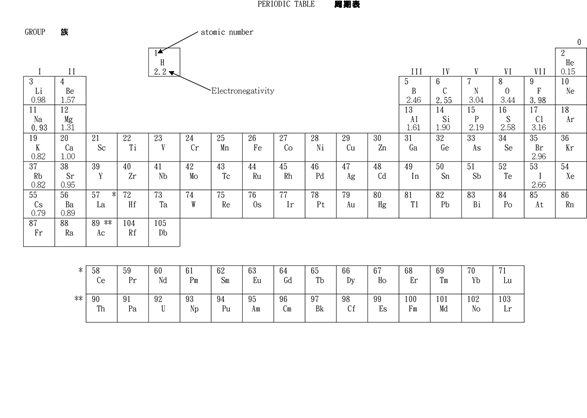
positively-charged)對成鍵電子(Bond electron, negatively-charged)的吸力有多強。不難想像,原子越細,Nucleus和bond electrons距離越近,吸力自然越強,所以在元素週期表中的元素週期越細(位置越高),原子越細(因為較少電子層),所以電負性就越高。
同樣道理,族越大、原子越細、所以電負性就越高。因此在表上右上角的氟(Fluorine)電負性最高(3.98),而在左下角的銫(cesium, Cs)的電負性則最低(0.79)。以下是週期表展示常見元素的電負性︰
Bond Polarity
以下面的分子為例,如果原子A和原子B的電負性一樣(即同一元素的原子),bond electrons就自然分佈在兩粒原子之間,所以A和B之間的共價鍵是非極性鍵(non-polar bond)︰
Hydrogen molecule就是其中一例,因為當中的共價鍵是由兩粒相同的原子組成,所以Bond electrons平均分佈於兩個原子之間,因此是non-polar bond︰
但如果原子B的電負性較大,Bond electron就被「拉」近到B,令B的電子密度變大,所以它帶負偶極(Partial negative
charge, δ-);而A的電子密度變細,所以它帶正偶極(Partial positive charge, δ+),所以A和B之間的共價鍵是極性鍵(polar bond)︰
用HCl為例,由於當中的共價鍵由兩粒不同的原子組成,所以Bond electrons會移向電負性高的原子(Cl),因此這個共價鍵是polar bond︰
呢度之所以要加Partial係positive/negative charge前面係因為該原子的電荷很少,比起ion因得到/放出一整粒電子而形成的電荷細得多,只是介乎在零至一之間。
同學可在Polar bond旁加上一箭咀(永遠由正指向負)來有效展示Bond polarity及分析Molecular polarity。(這個箭咀在化學上稱為dipole,在DSE不會考,但不要在考試中提及dipole等字眼)
總結黎講,同學要判斷一個鍵是否帶極性就視乎兩粒原子是否一樣即可。原子一樣就組成Non-polar bond;原子不一樣則組成polar bond。在Polar bond中電負性高的原子帶partial negative charge;電負性低的原子帶partial positive charge。
Molecular
Polarity
最後就睇晒成個分子是屬於polar molecule(即分子中的電子偏向其中一邊,所以一邊帶正、另一邊帶負)或Non-polar molecule(分子中的電子平均地分佈在每一邊)。如果分子帶有極性鍵而且不能互相抵消則為Polar molecule;如果分子沒有任何極性鍵,或帶有極性鍵但因分子對稱而令微電荷互相抵消則為Non-polar molecule。所以分辨一個分子是Polar還是non-polar的流程如下︰
相信同學閱讀完以上文字都唔會太知我講咩,所以都係繼續睇落去啦︰
Case 1: Water H2O
1.
呢個分子由兩款唔同既元素(H &
O)組成,所以可以係polar molecule
2.
先畫出水分子的形狀,Central
atom O有兩組bond pairs & lone pairs,所以分子形狀是V-shaped。
3.
找出分子的Polar bonds。在水分子中有兩個polar bond: O-H bond。因為O的電負性比H大,所以H和O分別是Partial +ve charge & partial –ve charge。在鍵旁邊加上箭咀,其方向就由帶正的H指向帶負的O。
4.
由於左右兩個dipole不能互相抵消(分子的O帶負、2個H帶正),所以H2O是polar molecule︰
Case 2:
Carbon dioxide CO2
1.
呢個分子由兩款唔同既元素(C &
O)組成,所以可以係polar molecule
2.
畫出二氧化碳分子的形狀,Central
atom O只有兩組bond pairs,所以分子形狀是linear。
3.
找出Polar bonds。這個分子有兩個polar bond: C=O bond。因為O的電負性比C大,所以C和O分別是Partial +ve charge & partial –ve charge。而顯示Bond polarity的箭咀方向就由帶正的C指向帶負的O。
4.
由於分子對稱,左右兩個dipole互相抵消,所以CO2是non-polar molecule︰
得字眼上既解釋係差左D既,所以呢度又想介紹大家玩Chemical model。今次是Molecular Polarity︰
一開始就係[Two Atoms]版本,大家先玩呢個。你可以係右邊set左View做Partial Charges、Surface揀Electrostatic Potential、Off左Electric Field之後就可以調校Atom A同B的Electronegativity。如果electronegativity高d個粒atom就會紅d同埋有δ-(Partial negative charge)、另一邊就會藍色而帶有+(Partial positive
charge)。最後可以係右邊開埋個Electric field,當轉個polar molecule或改變Atom A/B的Electronegativity之後就會令帶負的一邊轉向正極一方,反之亦然。
(Bond
dipole即是指向共價鍵較負的一邊、Bond character旨在解釋covalent和ionic bond之間的關係在於兩粒atoms之間electronegativity的大小。雖然DSE不用考,不過都可以了解多D。如果有唔明都歡迎問我。)
玩夠皮之後就可以轉去玩Real Molecules。同上段Setting差不多,不過Partial charges會轉為一些正或負的數字,代表正負極位置。跟住順手開埋Atom Electronegativities,大家就會注意到Electronegativity較大的Atom會帶負。
大家可試推斷以下分子是Polar molecule還是non-polar molecule,答案在下次講解DSE試題時公佈。
1. BF3
2. CH4
3. NH3








沒有留言:
張貼留言